

2022年7月8日,Molecular Neurobiology杂志(IF=5.68)发表了复旦大学附属金山医院神经内科祖恒兵教授团队的最新研究成果“DHCR24 Knockdown Induces Tau Hyperphosphorylation at Thr181, Ser199, Ser262, and Ser396 Sites via Activation of the Lipid Raft-Dependent Ras/MEK/ERK Signaling Pathway in C8D1A Astrocytes”。
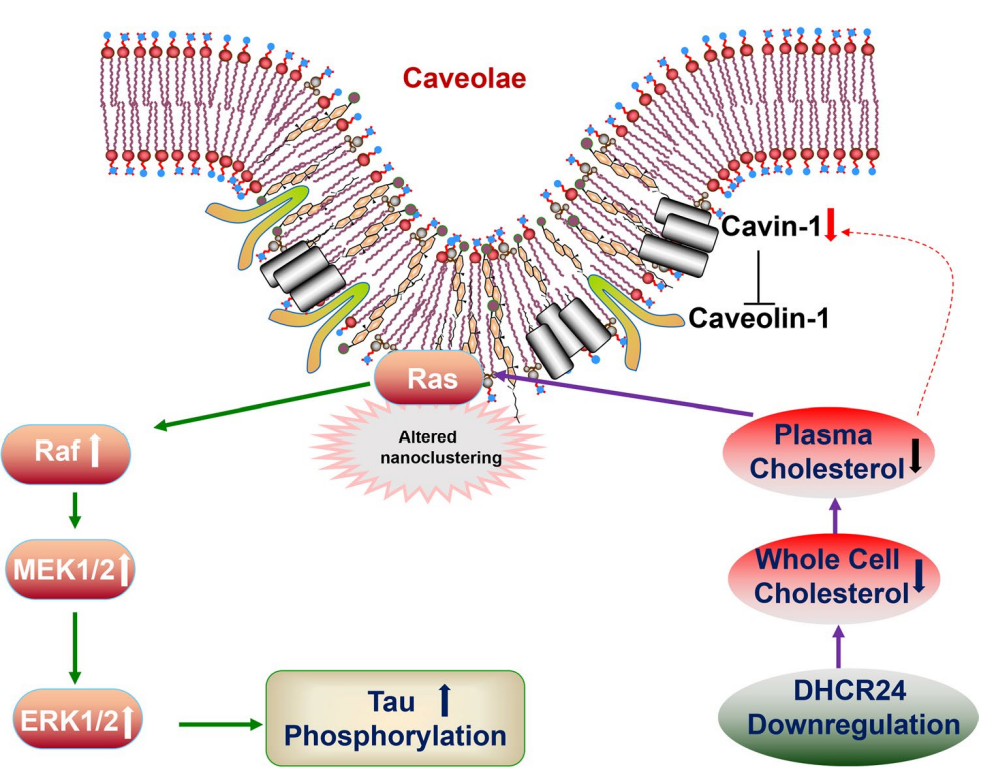
该研究揭示了星形胶质细胞胆固醇合成的下调在介导其自身tau蛋白异常磷酸化中的作用机制,提示星形胶质细胞胆固醇合成酶DHCR24表达下调后,细胞内合成胆固醇减少,导致膜胆固醇的含量下降以及膜脂筏的结构紊乱,从而激活了脂筏相关的Ras/MEK/ERK信号通路,最终促进tau蛋白的异常磷酸化。
研究背景
24-脱氢胆固醇还原酶(DHCR24)是胆固醇合成的关键酶。研究发现DHCR24在AD患者脑内表达明显下调,并且它的下调可以通过调控细胞胆固醇稳态促进神经元tau蛋白的异常磷酸化。以往针对AD tau病理的研究多聚集神经元,但最近研究发现AD患者及模型鼠的星形胶质细胞内也存在异常磷酸化的tau蛋白(p-tau)。目前关于星形细胞中p-tau来源的机制仍未阐明。星形细胞是脑内胆固醇合成的主要细胞,其DHCR24表达在AD小鼠脑内也是明显减少的。本研究旨在探讨星形细胞DHCR24表达变化是否可以通过影响细胞胆固醇稳态进而影响星形细胞本身tau蛋白的异常磷酸化。
研究发现
此次研究显示通过慢病毒感染C8D1A星形胶质细胞使DHCR24表达下调后,胆固醇染色及胆固醇合成代谢酶表达的变化提示细胞内及细胞膜胆固醇含量明显减少,导致了以胆固醇为主要成分的脂筏结构受损,激活了脂筏依赖的Ras/MEK/ERK信号通路。该信号通路的激活促进了C8D1A星形细胞tau蛋白在Thr181、Ser199、Thr231、Ser262和Ser396位点的过度磷酸化。
该研究是在上海市医药卫生发展基金会(NO. 201740209)以及上海市金山区卫生健康委员会(JSZK2015A05和JSZK2019A06)的资助下完成。复旦大学附属金山医院神经内科祖恒兵教授、邬军锋副主任医师为通讯作者,硕士研究生麦美婷为第一作者。

医学探索永远在路上,
闪光金医科研人,
快乐分享研究成果,
更多金医科研前沿,
敬请期待!