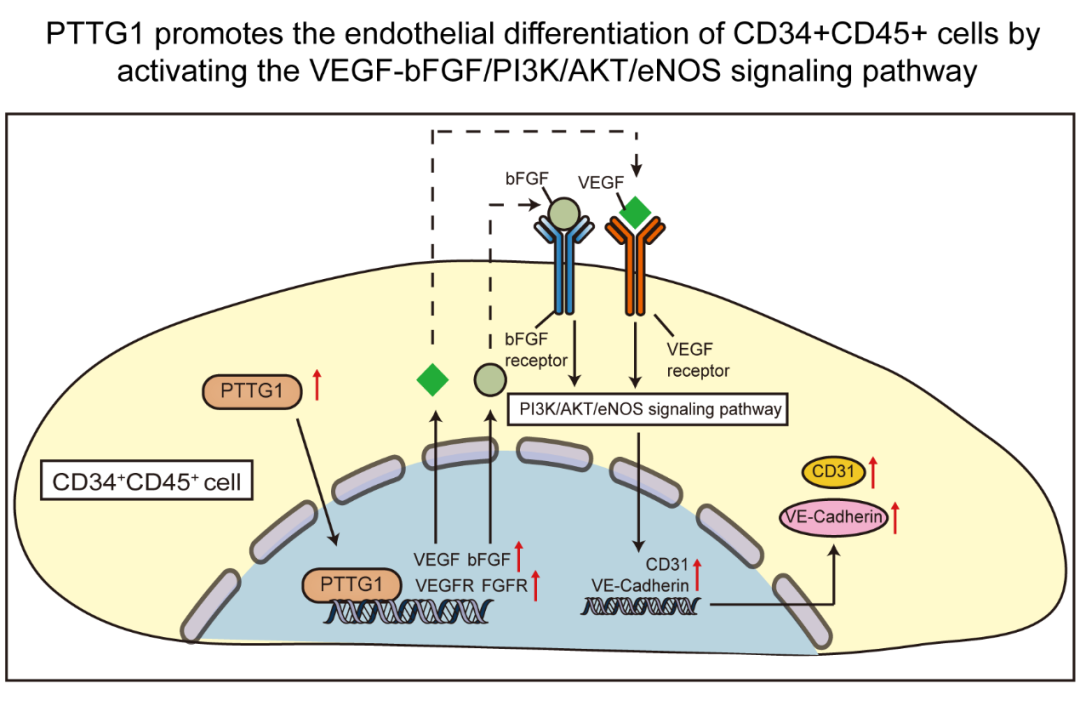
复旦大学附属金山医院急危重病中心申捷教授的最新研究成果“PTTG1 promotes CD34+CD45+cells to repair the pulmonary vascular barrier via activating the VEGF-bFGF/PI3K/AKT/eNOS signaling pathway in rats with phosgene-induced acute lung injury”发表在Biomedicine & Pharmacotherapy (IF: 7.419,JCR分区:Q1)杂志上。 该研究在课题组前期研究的基础上,通过体外内皮诱导培养、动物模型以及分子生物学实验证实前期通过单细胞测序在大鼠肺内发现的特殊细胞亚群——CD34+CD45+细胞具有内皮分化潜能,且垂体瘤转化基因1(PTTG1)可能通过激活VEGF-bFGF/PI3K/AKT/eNOS信号通路促进CD34+CD45+细胞向内皮分化,从而介导了CD34+CD45+细胞对光气吸入性肺损伤(P-ALI)肺血管内皮屏障的修复。该研究揭示了P-ALI时肺血管内皮屏障的修复机制,为肺内源性干细胞修复光气等有毒化学物质引起的化学源性急性肺损伤的肺血管屏障奠定了理论基础。
研究背景
光气吸入性肺损伤(P-ALI)的主要病理生理改变是肺气-血屏障的破坏,其中肺血管内皮屏障的破坏是导致疾病进展的关键因素。因此,靶向干预损伤的肺血管内皮屏障有望从根本上逆转疾病进程。前期该团队通过单细胞测序在大鼠肺内发现了一群对P-ALI的肺血管屏障具有修复作用的特殊细胞亚群——CD34+CD45+细胞,但该细胞亚群修复P-ALI肺血管屏障的具体机制尚不清楚。PTTG1作为CD34+CD45+细胞中Top10高表达的基因之一,被证实与血管形成密切相关,且其作用的发挥与PI3K/AKT信号通路有关。本研究旨在通过体外内皮诱导培养、动物模型以及分子生物学实验探讨CD34+CD45+细胞的干细胞属性,以及PTTG1是否介导CD34+CD45+细胞对P-ALI肺内皮屏障的修复作用,并探讨其潜在作用机制。
研究发现
首先,本研究通过体外内皮诱导培养,证实CD34+CD45+细胞具有内皮分化潜能。接下来,通过体内外实验证实了PTTG1通过促进CD34+CD45+细胞向内皮分化,从而介导了CD34+CD45+细胞对P-ALI肺血管屏障的修复作用。此外,本研究还证实PTTG1可以促进CD34+CD45+细胞VEGF、bFGF以及它们受体的表达。而VEGF和bFGF是PI3K/AKT信号通路的激活剂,从而进一步激活了PI3K/AKT/eNOS信号通路。并且激活PI3K/AKT/eNOS信号通路明显促进了CD34+CD45+细胞的内皮分化。综上,CD34+CD45+细胞具有内皮分化潜能,PTTG1可通过激活VEGF-bFGF/PI3K/AKT/eNOS信号通路促进CD34+CD45+细胞向内皮分化,进而介导了CD34+CD45+细胞对P-ALI肺血管内皮屏障的修复。 该论文第一作者为申捷教授的硕士研究生敦宇,申捷教授为通讯作者。该研究受到国家自然科学基金(NO. 82272243)、上海市公共卫生体系重点学科建设计划(NO. GWV-10.1-XK26)、金山区医学重点专科建设项目(JSZK2019A01)和金山医院人才队伍建设三年行动计划学科平台建设(XPT-2020-3)课题的资助。 医学探索永远在路上, 闪光金医科研人, 快乐分享研究成果, 更多金医科研前沿, 敬请期待!